
近日,我校附屬第三醫院內分泌與代謝病學科陳燕銘教授團隊與臨床免疫學中心魯巖副研究員、謝池楚博士共同在免疫學高水平雜志Cellular & Molecular Immunology(2021 IF:8.5)發表原創研究成果,題目為“Induced Regulatory T cells suppress Tc1 cells through TGF-β signaling to ameliorate STZ induced type 1 diabetes mellitus”。我校附屬第三醫院周麗博士生為論文的第一作者,魯巖主任和陳燕銘教授為論文共同通訊作者。
1型糖尿病(T1DM)是一種自身免疫介導的器官特異性疾病,導致胰島β細胞選擇性被破壞,不能產生足夠數量的胰島素。多數青少年患者起病急,癥狀較明顯,嚴重時可出現糖尿病酮癥酸中毒。最理想的治療方法是針對該疾病的免疫發病機制來預防和逆轉T1DM。近年來,在國家科技部重點研發項目的支持下,陳燕銘教授團隊一直致力于免疫干預治療T1DM的基礎與臨床前期研究,包括調節性T細胞(Tregs)、干細胞治療糖尿病,通過抑制自身免疫應答或胰島β細胞替代,可以延緩胰島β細胞功能的衰退、短期內脫離胰島素治療或減少血糖的大幅波動,達到明顯臨床療效。
團隊研究發現,體外誘導的Tregs有預防及治療T1DM小鼠[其中包括鏈脲佐菌素(STZ)誘導的T1DM模型及自發T1DM小鼠模型(NOD小鼠)]的效果,其療效與降低小鼠脾臟及淋巴結中1型細胞毒性T(Tc1)細胞(分泌IFN-γ的CD8+ T細胞)及上調Tregs有關。研究也發現,誘導型Tregs(iTregs)的作用依賴于TGF-β信號通路。iTregs通過TGF-β抑制對Tc1細胞分化具有重要作用的mTOR信號通路的激活。另外,TCF1分子可抑制Tc1的分化,而iTregs可通過TGF-β信號通路維持TCF1的高表達,從而抑制Tc1分化。該研究首次系統證實iTregs在T1DM治療中的作用,同時闡明起關鍵調控作用的信號通路,為T1DM的免疫干預治療提供了新思路,具有重要的應用前景。
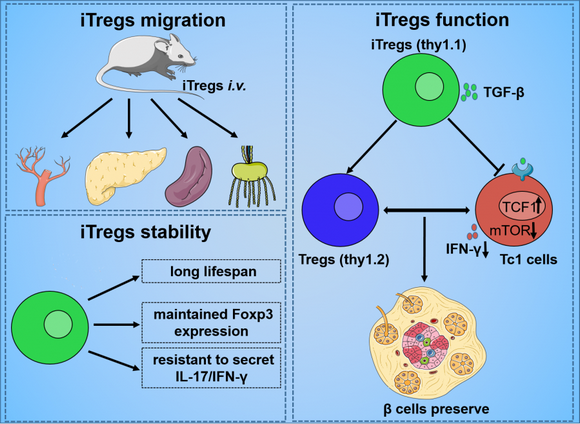
圖. STZ-T1DM小鼠iTregs遷移、穩定性及功能模型。iTregs遷移到PBMCs、胰腺、脾臟和淋巴結。iTregs在STZ-T1DM小鼠體內至少存活30天且保持穩定,這表明Foxp3的表達保持不變,并抵抗IL-17和IFN-γ的分泌。iTregs可以保護β細胞功能,可能通過上調受體小鼠的Treg水平,抑制Tc1細胞功能,從而重新平衡受體的Treg/Tc1細胞比例。iTregs對Tc1細胞的作用依賴于TGF-β介導的mTOR和TCF1信號通路的聯合作用。