
近日,我校醫學院郭德銀教授團隊在國際知名期刊Proceedings of the National Academy of Sciences of the United States of America (PNAS)雜志在線發表了題為“An unconventional role of an ASB family protein in NF-κB activation and inflammatory response during microbial infection and colitis”的研究論文(Hou et al., 2021)。
炎癥反應的精細調控對控制微生物感染和炎癥性疾病至關重要。郭德銀教授課題組發現ASB蛋白家族中的ASB1通過調節TAB2蛋白的穩定性促進其下游NF-κB和MAPK信號通路活性從而正向調控了炎癥反應。且ASB1缺失的小鼠對細菌感染或細菌脂多糖(LPS)所誘導的膿毒癥抵御能力增強,體內炎癥反應降低,炎性細胞浸潤和組織損傷減輕,存活率升高。此外,在葡聚糖硫酸鈉(DSS)誘導的慢性炎癥性腸炎模型中,ASB1缺失的小鼠的炎癥反應也顯著下降。這一發現對于理解炎癥性疾病和制定與ASB家族蛋白相關的干預措施具有重要意義。博士后侯盼盼,博士生賈鵬輝和碩士生楊孔祥為論文共同第一作者,郭德銀教授為通訊作者,我校醫學院為第一完成單位。
NF-κB和MAPK依賴的信號通路對機體炎癥反應具有重要作用。在信號轉導過程中,TAB2/ TAB3作為TAK1復合體的一部分,與TRAF6或RIP1結合的K63多泛素鏈結合,激活NF-κB和JNK/p38信號通路,以此來響應TNFR或TLR的激活。然而,免疫反應和炎癥反應在病原體感染條件下,尤其是炎癥性疾病中的精細調控仍知之甚少。郭德銀教授課題組利用CRISPR/Cas9第二代文庫在免疫細胞中進行了全基因組水平的大規模無偏差篩選,發現了一系列參與天然免疫反應調控的新型基因。篩選系統中顯示ASB1缺失后,病毒感染誘導的一型干擾素表達水平顯著性下降。通過進一步研究,作者發現ASB1可正向調節NF-κB信號通路。該蛋白因子被認為是ECS E3泛素連接酶復合體中的底物識別蛋白,介導底物的K48型泛素化和隨后的泛素-蛋白酶體途徑依賴地降解。作者發現ASB1在LPS和細胞因子TNFα和IL-1β的刺激下表達增加,正反饋調節LPS和細胞因子誘導的NF-κB信號通路活性,無論是在細胞系還是小鼠原代細胞BMDM和BMDC中都顯示了一致的現象。在生理水平上,ASB1缺失的小鼠對LPS和鼠傷寒沙門氏菌誘導的膿毒癥反應減弱,對細菌和病毒的清除能力降低,這些結果表明ASB1通過調控NF-κB信號通路調控了機體的炎癥反應。更有意思的是,ASB1缺失的小鼠對DSS誘導的炎癥性腸炎的炎癥反應減弱,體重減輕變慢,體內的炎癥因子表達水平下降,小鼠存活率提高。這一結果表明ASB1在無外源感染的狀態下也可以調控機體自身的炎癥反應。在機制上,ASB1的ANK功能域介導其與NF-κB信號通路中的關鍵節點蛋白TAB2/TAB3相互作用,抑制了它們K48型的泛素化,促進了TAB2/TAB3的蛋白穩定性,從而增強了TAB2/TAB3/TAK1介導的NF-κB和MAPK信號通路的激活,進而正向調控了炎癥反應。工作機制如下圖。
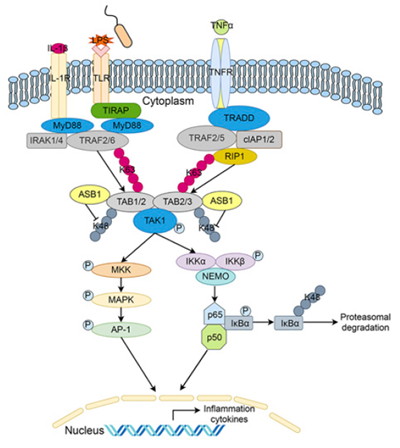
ASB1調控炎癥反應的示意圖
ASB蛋白屬于SOCS超家族,ASB蛋白通過識別特定底物并介導底物的K48泛素化及隨后的泛素-蛋白酶體途徑依賴地降解來調節細胞因子信號通路和一些腫瘤相關通路。不同的是,該研究揭示了ASB1不同于其他含SOCS box蛋白的功能。它不僅抑制了底物TAB2的K48泛素化,反而促進了底物的穩定性。因此,該研究鑒定了ASB家族蛋白的一個不同于其他SOCS box成員的功能。以上這些結果說明,ASB1不僅可在免疫細胞中發揮調節炎癥的作用,而且還在各種炎癥性疾病模型中也具有同等重要的生理作用。鑒于這種重要作用,以ASB1為靶點設計藥物可能在抗微生物感染免疫和炎癥性疾病中具有重要意義。