
N6-甲基腺嘌呤(N6-methyladenosine, m6A)作為真核生物mRNA上含量最豐富的化學修飾之一,幾乎參與了所有轉錄后調控過程,包括RNA的剪接、加工、轉運、降解及翻譯等。相關領域的前期研究表明:在胚胎干細胞(Embryonic Stem Cells,ESCs)中m6A甲基轉移酶METTL3敲除后,會引起全轉錄組范圍甲基化水平下調并導致ESCs分化障礙,從而提示m6A修飾在早期胚胎發育中發揮著十分重要的作用。由于在ESCs中缺乏對單個m6A修飾進行精確調控的工具,METTL3敲除導致的ESCs分化缺陷是由單一位點RNA甲基化事件引起的,還是由多個m6A修飾位點協同作用引起的?單個m6A位點修飾的改變是否足以決定細胞命運?這些科學問題仍未被闡明。
我校中山醫學院曹楠教授課題組和生命科學學院駱觀正教授課題組合作,在人ESCs(hESCs)中開發了針對特定m6A位點甲基化水平進行精確可逆調控的新工具TRME(Targeted RNA m6A Erasure)。利用這一新工具,研究團隊發現對SOX2基因mRNA單位點m6A修飾的擦除即可抑制hESCs向中內胚層分化,并促進其向外胚層轉化,改變了hESCs分化命運。
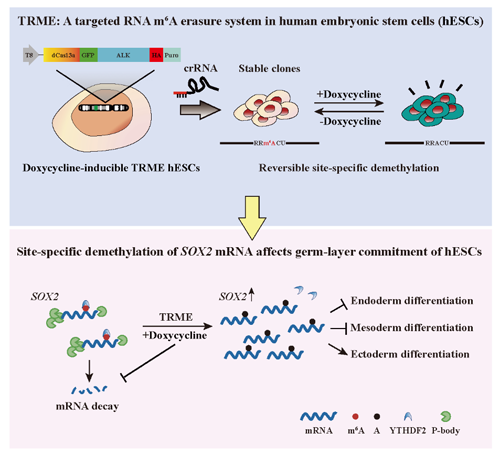
圖 hESCs單位點m6A編輯工具的建立及其在細胞命運調控研究中的應用
該研究開發了在ESCs中對單位點m6A修飾進行精確調控的新方法,從而為在ESCs中進行RNA表觀遺傳學研究奠定了基礎,為解析干細胞分化機理提供了新的平臺和切入點。證明了單個m6A位點的去甲基化即足以影響干細胞命運抉擇。
該項研究成果“Targeted RNA N6-Methyladenosine Demethylation Controls Cell Fate Transition in Human Pluripotent Stem Cells” 近日在Advanced Science(中科院一區)上在線發表。中山醫學院博士生陳雪娜、趙清泉及生命科學學院博士生趙玉莉為論文共同第一作者。中山醫學院曹楠教授、王嘉副研究員和生命科學學院駱觀正教授為論文共同通訊作者。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202003902