
中大新聞網訊(通訊員孫遠帆)中山大學張銳教授團隊日前在國際生物技術頂級期刊Nature Biotechnology發表重要研究成果。該研究首次提出名為MIRROR的全新內源性ADAR招募gRNA設計理念,顯著提高了RNA編輯效率,這一突破為RNA編輯技術走向臨床應用注入了強勁動力,同時也為相關疾病的精準治療描繪了全新藍圖。
與傳統DNA編輯不同,RNA編輯避免了對基因組的永久性修改,其可控、可逆的特性大幅提升了基因治療的安全性。特別是基于內源性ADAR的RNA編輯系統,能有效規避外源酶過表達可能引發的全局脫靶效應和潛在致癌風險,加之遞送系統成熟,其安全性和成藥性被業界廣泛看好,成為RNA編輯藥物研發最具潛力的方向。
然而,基于內源性ADAR的RNA編輯技術目前面臨效率較低的瓶頸。傳統ADAR gRNA設計通常采用完全互補的特異性域,但研究顯示這種結構并非ADAR的最佳底物。研究團隊開發出模擬天然底物構象的gRNA設計算法,并經高通量篩選得到高效MIRROR gRNA。實驗結果表明,MIRROR gRNA的編輯效率最高可達傳統gRNA的5.7倍,在小鼠體內實現了超過80%的編輯效率。
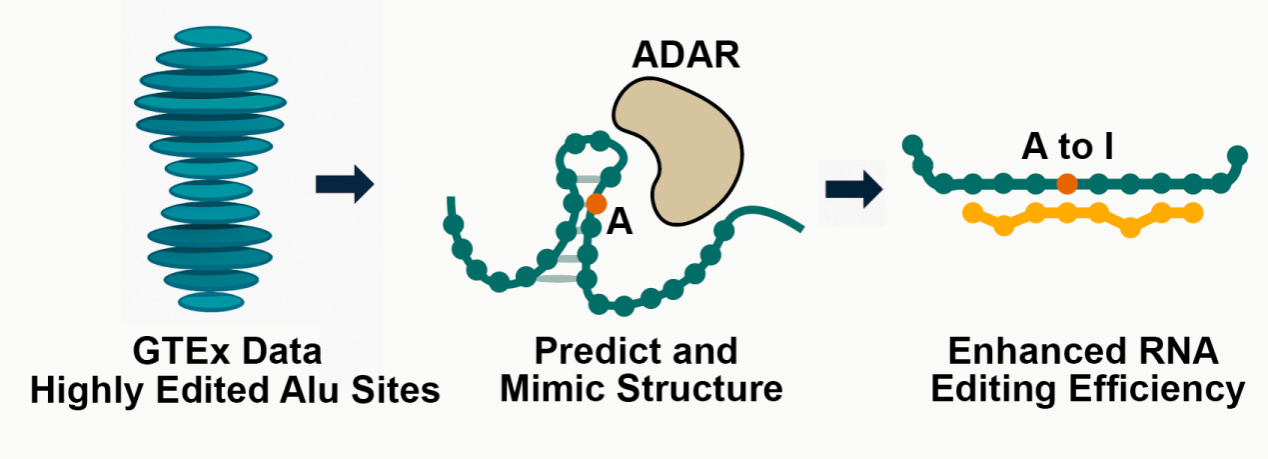
“我們利用短鏈修飾化的MIRROR gRNA 在細胞模型中成功修復了α1-抗胰蛋白酶缺乏癥基因SERPINA1的E342K致病突變,編輯效率高達90%以上,這展示了 MIRROR在精準治療遺傳性疾病方面的巨大潛力。”張銳說。
原文鏈接: https://www.nature.com/articles/s41587-025-02628-6