
中大新聞網訊(通訊員趙宜鵬、言誠開、陳晨)近日,附屬第三醫院腦病中心邱偉團隊聯合香港中文大學劉曉東團隊在國際期刊Nature Communications(中科院一區)發表題為 “Astrocyte Derived Clusterin Disrupts Glial Physiology to Obstruct Remyelination in Mouse Models of Demyelinating Diseases”的研究論文。
多發性硬化(MS)是西方人群最為常見的神經系統疾病之一(>1/10000患病率),而東方人群相對少見(<1/10萬患病率),2018年中國官方將其列為罕見病。MS為一種經典的免疫介導的脫髓鞘疾病。正常情況下,機體具備自我修復功能,能夠促使少突膠質前體細胞(OPC)分化成少突膠質細胞(OL)并生產髓鞘從而修復損傷;然而在慢性病程中,髓鞘再生過程常受阻礙,導致MS患者病情惡化進展。
CLU在MS患者及動物模型腦組織中表達
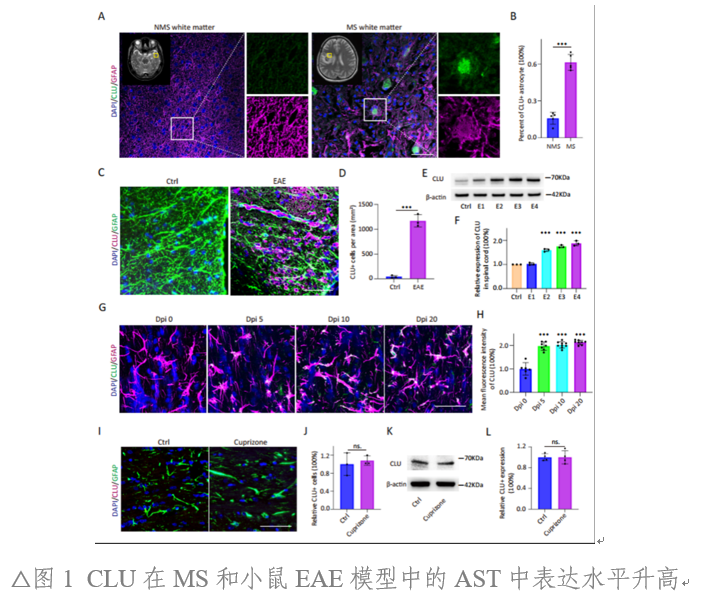
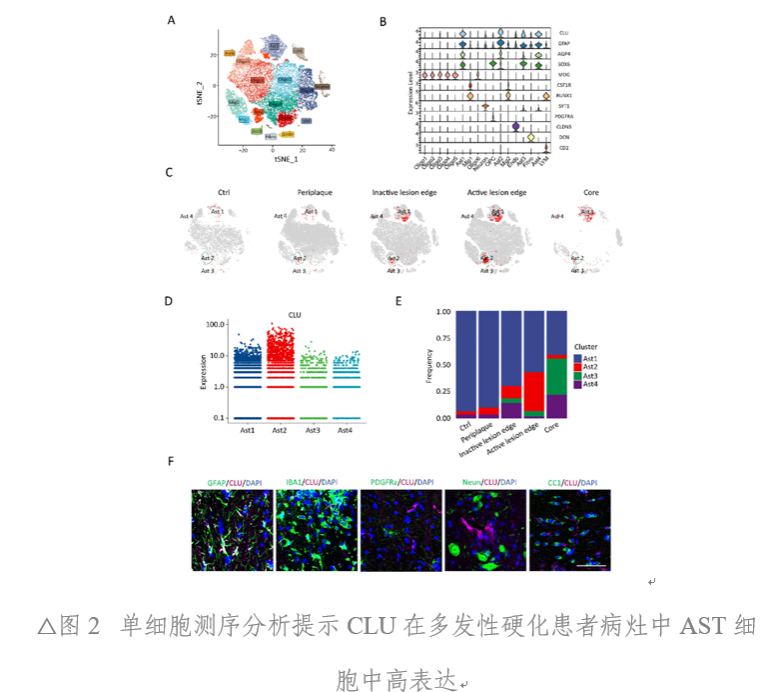
MS患者標本結合已公開發表的測序數據顯示,星形膠質細胞(AST)在活躍的病灶區域呈現顯著的Clusterin(CLU)高表達。另外,在EAE和LPC誘導的脫髓鞘模型病灶中,也觀察到AST細胞CLU表達上調。且EAE中CLU表達水平與EAE殘疾評分存在顯著相關。然而,在銅腙誘導的非炎癥脫髓鞘模型中,并未出現CLU表達上調。證明,CLU僅在“炎性”脫髓鞘環境中AST細胞的特異性上調(圖1、圖2)。
CLU可抑制AST細胞吞噬髓鞘碎片功能
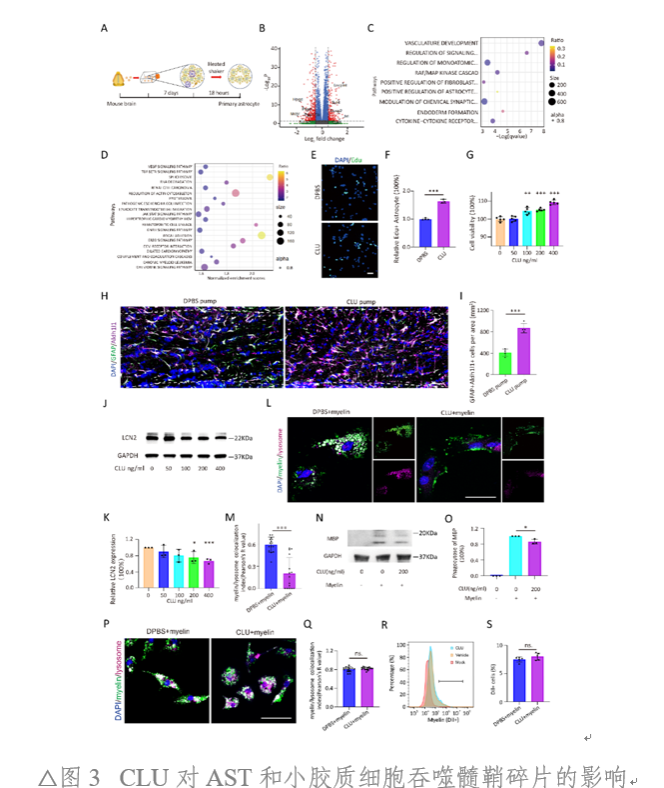
通過RNAseq,研究人員探究了CLU對AST細胞增殖和功能影響。利用體內、外增殖實驗,研究人員成功驗證了CLU對AST細胞增殖的促進作用。另一方面,體外實驗證實CLU可抑制AST細胞的髓鞘吞噬功能(圖3)。因此,CLU在神經系統中對AST起重要作用。
CLU可損傷OL和OPC并導致髓鞘缺失
通過RNAseq,研究發現 CLU在3h即可顯著下調與OPC分化及髓鞘形成緊密相關的基因表達。在24h刺激后, CLU暴露與Pi3k-Akt信號通路抑制緊密相關。研究人員進一步行體外刺激實驗,證實CLU會導致OPC的分化與成熟異常,同時觀察到其增殖能力下降和凋亡率上升。
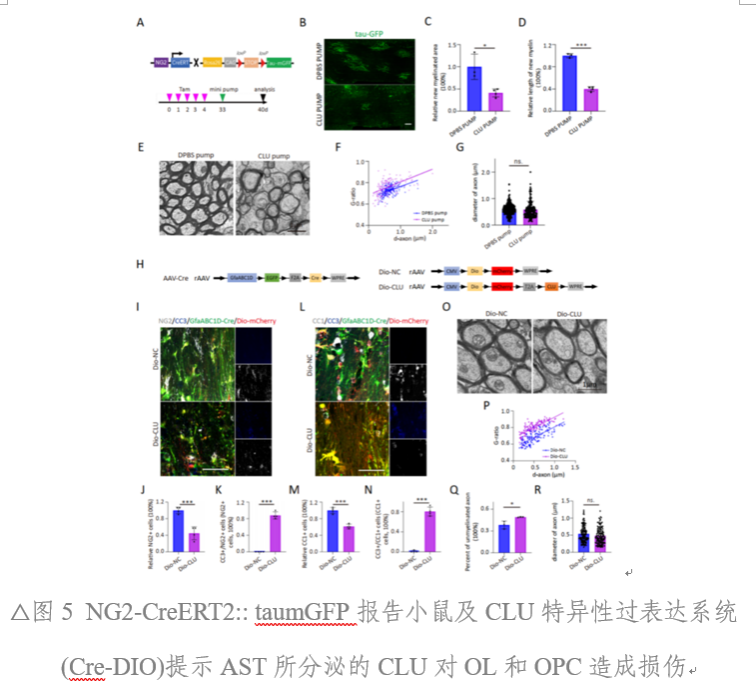
基于NG2-CreERT2:: taumGFP報告小鼠的實驗模型,研究人員觀察到外源性CLU的持續泵入會導致GFP+新生髓鞘減少,以及髓鞘厚度的顯著降低。此外,利用Cre-DIO系統在AST過表達CLU后,也觀察到相同結果。綜上所述,在病理狀態下,AST分泌的CLU會對OPC和OL造成損傷(圖4、圖5)。

CLU對OL和OPC的損傷由VLDLR介導
研究發現OL和OPC持續穩定地表達VLDLR,而AST細胞則主要表達ApoER2受體。研究人員進一步采用NG2啟動子慢病毒介導的特異性敲低技術,針對NG2+ OPC細胞中的VLDLR進行敲低操作。結果表明,VLDLR敲低后,OPC中的EDU+細胞比例顯著增加,而CC3+細胞比例顯著降低。因此,VLDLR的減少可以有效緩解CLU對OPC的損傷作用。
Pi3k-Akt通路是CLU誘導OPC損傷的重要機制
在體外實驗中,研究人員通過測序揭示CLU對Pi3k-Akt通路的抑制作用。隨后,通過采用緩釋泵系統為外源性CLU暴露小鼠分別注射了Akt激動劑SC79與拮抗劑MK2206。結果發現SC79能夠部分逆轉由CLU暴露引起的OL和OPC數量減少;MK2206則加劇OL和OPC的損害。因此,CLU通過抑制Pi3k-Akt通路,導致了OL和OPC的損傷。
附屬第三醫院CLU敲低與敲除可提高小鼠脫髓鞘病灶的髓鞘修復
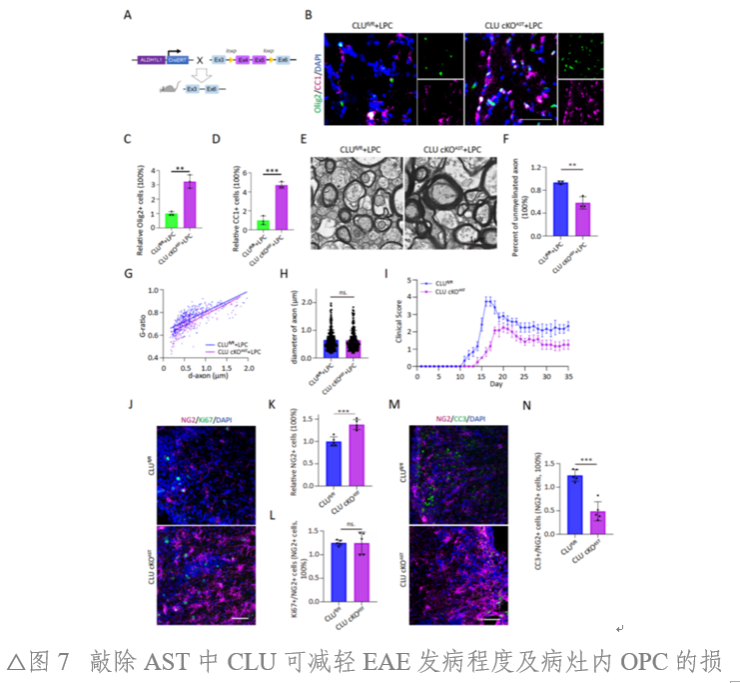
利用攜帶shCLU的AAV敲低小鼠胼胝體區的CLU表達,或借助GfaABC1D-Cre-EGFP特異性地敲除CLUfl/fl小鼠胼胝體區AST細胞的CLU。隨后,對這些小鼠建立LPC脫髓鞘模型。結果顯示CLU敲低與敲除顯著提高了LPC脫髓鞘病灶區域內OPC和OL細胞數量和髓鞘厚度。研究人員進一步構建了ALDH1L1-CreERT::CLUfl/fl條件敲除小鼠,并進行EAE造模。結果顯示,條件敲除小鼠相較于對照組表現出較低的疾病發病水平,且其脊髓病灶中的OPC的凋亡現象有所緩解。提示AST細胞上CLU的敲除可能具有髓鞘保護效應(圖6、圖7)。

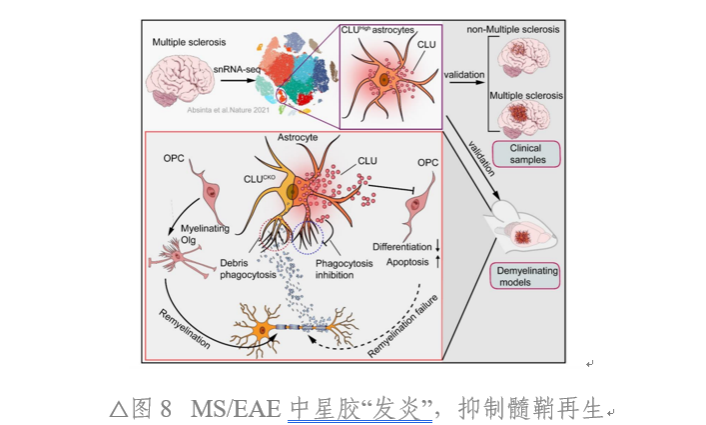
本研究揭示了AST在病理免疫狀態下(如MS/EAE)促進CLU表達,CLU通過作用于OPC的VLDLR受體,抑制Pi3k-Akt通路,最終損傷OPC和阻礙髓鞘再生的關鍵機制。同時,該研究闡明了,MS中髓鞘損傷及再生受阻的新機制,為MS預后判斷提供了新的生物標記物,同時為MS治療提供了全新的靶點和方向。
附屬第三醫院腦病中心陳晨博士、舒崖清副教授、言誠開博士后為共同第一作者;腦病中心邱偉教授、秦峰主任醫師,香港中文大學劉曉東教授為共同通訊作者。該研究得到了陸軍軍醫大學梅峰、海南省人民醫院黃仕雄、廣東三九腦科醫院王展航等專家的支持。
原文鏈接:https://www.nature.com/articles/s41467-024-52142-7