
中大新聞網訊(通訊員張玉琦)心律失常(Arrhythmia)影響著全球超過1200萬人,且發病率也在不斷上升,是心源性猝死的主要原因之一。心律失常誘發因素眾多,研究表明交感神經系統(Sympathetic nervous system, SNS)活動異常和心外膜脂肪(Epicardial adipose tissue, EAT)增厚是心律失常發生的重要的獨立風險因素。心外膜脂肪包繞著大部分心臟交感神經,兩者特殊的位置關系提示心外膜脂肪和心交感神經之間的相互作用可能在心律失常發生中扮演重要的角色。然而,由于物種差異和倫理限制,目前尚無直接證據證明脂肪-交感神經相互作用參與心律失常的發生。
近日,中山大學中山醫學院李偉強教授、項鵬教授團隊、中山大學附屬第三醫院朱潔明教授團隊和高州市人民醫院朱秀龍教授團隊合作在Cell Reports Medicine雜志上發表題為“The adipose-neural axis is involved in epicardial adipose tissue-related cardiac arrhythmias”的文章,成功揭示了心外膜脂肪-心交感神經在心律失常中的重要作用并解析了其作用機制。
該研究利用干細胞來源的心肌細胞、交感神經元和脂肪細胞建立了交感-心肌、脂肪上清-心肌、脂肪上清-交感-心肌等三種不同的共培養體系,檢測這些共培養條件下心肌細胞的鈣瞬變情況(鈣瞬變是由興奮沖動所誘發的心肌細胞胞質內瞬時性鈣增高,是心肌細胞重要的Ca2+處理特性,與心肌細胞收縮節律密切相關)。結果發現,心肌細胞與脂肪上清或交感神經共培養時,心肌細胞發生鈣瞬異常的頻率較未處理的心肌細胞無顯著改變;然而,培養體系中同時加入脂肪上清和交感神經時(即三者共培養組),心肌細胞鈣瞬變異常的發生頻率明顯高于其他兩兩共培養體系。同時,微電極陣列檢測結果顯示三者共培養組中,心肌細胞電傳導模式改變,發生類似心律失常樣改變。進一步研究發現,脂肪細胞因子leptin通過leptin受體激活SOCS3進而抑制JAK2/SATA3通路,促使交感神經分泌更高水平的神經遞質。同時,該研究發現,交感神經主要依賴于神經肽Y(NPY)與Y1R的相互作用導致心肌細胞的節律異常。 臨床數據進一步表明,心外膜脂肪增厚的房顫患者其冠狀竇血清中NPY的含量遠高于非心外膜脂肪增厚的房顫患者,且與房顫的嚴重程度呈正相關。
最后,研究人員探討了NPY誘發心肌細胞節律異常的分子機制,發現三者共培養組的心肌細胞內鈣/鈣調蛋白依賴性蛋白激酶 II (CaMKⅡ)、鈉鈣交換體(NCX)活性升高,導致延遲后除極(DADs)增加,引起心肌細胞鈣瞬變異常,產生心律失常樣改變。而Y1受體抑制劑、CaMKⅡ抑制劑、NCX抑制劑可以有效阻斷NPY的致心律失常作用。
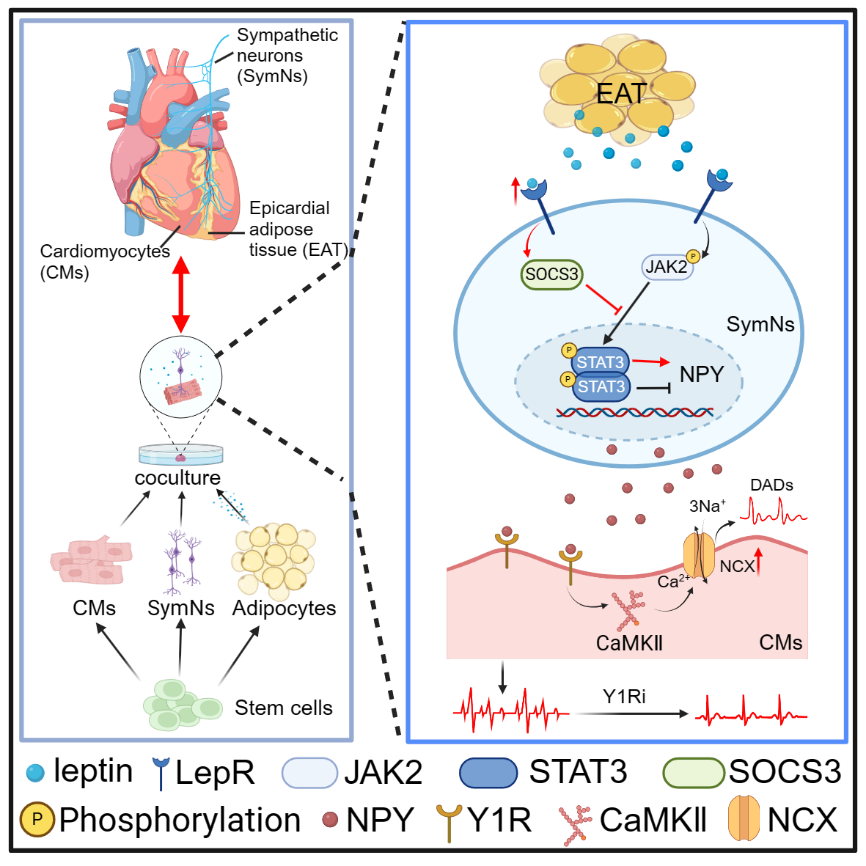
綜上所述,該研究通過建立共培養模型模擬心臟組織微環境,深入探討心外膜脂肪相關心律失常的發生機理。研究結果表明,脂肪因子leptin激活交感神經,促使其分泌更高水平的NPY。NPY通過Y1R受體引起心肌細胞內鈣穩態異常,誘發心肌細胞心律失常樣改變。抑制Y1R和下游鈣信號相關蛋白可以有效阻斷NPY的作用。該研究證實脂肪-神經軸參與心律失常的發生,為心律失常的治療提供了潛在的新靶點。同時,也為研究EAT/ 交感神經系統相關疾病的發病機制、探索預防/治療策略提供有力的工具。
中山大學中山醫學院的李偉強教授、項鵬教授,中山大學附屬第三醫院朱潔明教授和高州市人民醫院朱秀龍教授為共同通訊作者;團隊成員范玉寶博士、黃珊珊博士和李蘇華副主任醫師為共同第一作者。